2020年4月9日,中国农业大学生物学院陈忠周教授在Vaccines杂志上在线发表了题为“The Function of the PRRSV–Host Interactions and Their Effects on Viral Replication and Propagation in Antiviral Strategies”的文章。 猪繁殖与呼吸综合征病毒(PRRSV)影响着全球养猪业,每年巨大的经济损失。PRRSV的基因组是一个约15kb的包膜单链正义RNA。PRRSV主要在猪肺和淋巴器官的肺泡巨噬细胞中复制,导致母猪繁殖问题和仔猪呼吸道症状, 迄今为止,有关PRRSV如何在宿主中存活、宿主对病毒感染的免疫反应以及发病机制的研究已经有报道。PRRSV疫苗包括灭活病毒、改良活病毒、减毒活疫苗、DNA疫苗和免疫佐剂疫苗。然而,已获许可的疫苗的持久性和有效性存在某些问题。此外,这种RNA病毒的高变异性和快速进化的群体对PRRSV疫苗的设计提出了挑战,因此针对PRRSV的有效疫苗尚未成功开发, 众所周知,病毒与宿主相互作用,逃避宿主的免疫应答,然后在宿主体内复制繁殖,这是病毒生存的关键。在此,我们综述了PRRSV-宿主相互作用在病毒感染过程中的复杂网络和机制。通过研究这些宿主-病毒的相互作用和结构,开发新的PRRSV抗病毒策略,对更好地理解PRRSV免疫逃逸的分子机制至关重要。 PRRSV的复制和感染周期,包括病毒粒子的结合、内化、脱壳、翻译、组装、释放和免疫应答。细胞因子IFN-α/β首先刺激宿主对PRRSV感染的先天性和适应性免疫应答。在这个过程中,一些重要的病毒结构蛋白和非结构蛋白与宿主因子相互作用。 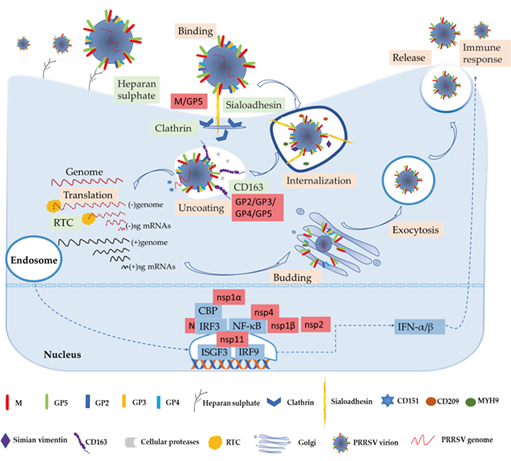
图1. PRRSV的复制和感染周期 PRRSV进入和感染的整个过程中,复杂的病毒-宿主相互作用网络是必不可少的。病毒结构蛋白与宿主受体相互作用介导病毒侵入。宿主和病毒非结构蛋白的相互作用会影响病毒基因组的复制和转录。病毒的入侵引起一系列免疫反应,病毒粒子通过与宿主的相互作用,从宿主的免疫系统中逃逸,有利于自身的复制。只有更好地了解PRRSV免疫逃避和调节的分子机制,才能设计出更有效的疫苗。对这些宿主-病毒相互作用的进一步研究对于开发新的PRRSV抗病毒策略至关重要。
Host | PRRSV | Function | Virus Genotypes | References | Heparan | M/GP5 | Concentrate virions on the cell surface | PRRSV-1/ PRRSV-2 | [15] | pSn | M/GP5 | PRRSV attachment and internalization receptor via clathrin-mediated endocytosis | PRRSV-1 | [16] | CD163 (5JFB) | GP2/GP3/ GP4/GP5 | Uncoating and genome release | PRRSV-1/ PRRSV-2 | [13,17] | CD151 | 3′ UTR RNA | Cooperate in infection | PRRSV-2 | [18] | Simian vimentin | N (1P65) | Mediate transportation of the virus in the cytosol | PRRSV-2 | [19] | CD209 | GP5 | Essential in PRRSV entry and infection | PRRSV-1/ PRRSV-2 | [20] | MYH9 | GP5 | Essential in PRRSV entry and infection | PRRSV-1/ PRRSV-2 | [21,22] |
IFN-β | nsp1α (3IFU) | Suppress IFN by degrading CBP | PRRSV-2 | [23,24] | nsp1β (3MTV) | Suppress IFN by inhibiting both IRF-3 and NF-κB-dependent gene induction | PRRSV-2 | [25] | N | Suppress IFN by inhibiting the phosphorylation and nuclear translocation of IRF3 | PRRSV-2 | [26] | nsp2 | Suppress IFN by inhibiting the activation of the IRF-3 and NF-κB signaling | PRRSV-2 | [27] | nsp4 (5Y4L) | Suppress IFN by blocking NF-κB activation | PRRSV-2 | [28] | nsp11 (5EYI) | Suppress IFN by inhibiting the activation of the IRF-3 and NF-κB signaling, and inhibiting the formation and nuclear translocation of ISGF3 targeting IRF9 | PRRSV-2 | [29–31] | IL-1β | E | Increase the release of IL-1β | PRRSV-2 | [32] | nsp11 | Inhibit the secretion of IL-1β | PRRSV-2 | [33] | IL-10 | N | Up-regulate IL-10 via NF-κB and p38 MAPK pathways in PAMs | PRRSV-2 | [34] | nsp1 | Up-regulate IL-10 | PRRSV-2 | [35] | Gp5 | Up-regulate IL-10 through p38 MAPK and signal transducer and activator of transcription-3 (STAT3) activation | PRRSV-2 | [36] | IL-17 | nsp11 | Induced IL-17 productiondepending on the PI3K-p38MAPK-C/EBPβ/CREB pathways | PRRSV-2 | [37] | TRIM25 | N | Competitively interact with TRIM25, thereby interfering with TRIM25-mediated RIG-I ubiquitination | PRRSV-2 | [38] | TRIM22 | N | Interact with TRIM22 thereby reducing virus replication | PRRSV-2 | [39] | TRIM59 | nsp11 | Interact with TRIM59 thereby reducing virus replication | PRRSV-2 | [40] | MiR-181 | ORF4 | Inhibit PRRSV replication | PRRSV-2 | [41,42] | MiR-130 | 5′ UTR | PRRSV-2 | [43] | MiR-23 | ORF3 | PRRSV-2 | [44] | MiR-378 | ORF7 | PRRSV-2 | [44] | MiR-505 | ORF3/ORF5 | PRRSV-2 | [44] | PIAS1 SLA-I(5YLX) | nsp1α | Modulate degradation via SUMO E3 ligase activity | PRRSV-2 PRRSV-2 | [45] [45,46] | Nup62 | nsp1β | Inhibit host antiviral protein expression | PRRSV-1/ PRRSV-2 | [47] | STAT3 | nsp5 | Promote the degradation of STAT3 and interference with the JAK/STAT3 signaling | PRRSV-1/ PRRSV-2 | [48] | pRb | nsp9 | Benefit the replication of PRRSV | PRRSV-2 | [49] | NLRX1 | nsp9 | Restrict PRRSV replication | PRRSV-2 | [50] | ZAP | nsp9 | Repress PRRSV replication. | PRRSV-2 | [51] | Fibrillarin Nucleolin Poly(A)-binding | N | Function remains to be further clarified | PRRSV-2 | [52] |
表1. 猪繁殖与呼吸综合征病毒(PRRSV)-宿主相互作用及其功能 与肽nsp9-TMP9的pSLA-1*1502(pSLA-1*1502,PDB code: 5YLX))的复合物晶体结构提供了研究结构基础,整体结构与pSLA-1*0401 (PDB code: 3QQ3)和pSLA-3*hs0202 (PDB code: 5H94)非常相似,D口袋显示的结构信息对确定和固定结合肽起着至关重要的作用,并为设计有效的肽疫苗提供了结构基础。 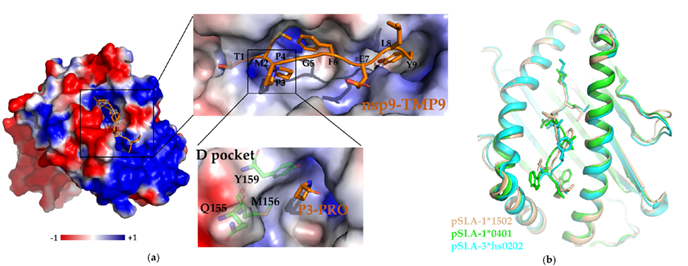
图2. pSLA-1*1502的D pocket结构与nsp9-TMP9肽结合,并对解析的三种pSLA结构的肽构象进行比较 综上所述,我们综述了PRRSV-宿主相互作用网络和疫苗研究进展,通过研究PRRSV-宿主相互作用在整个过程中的作用,全面了解PRRSV复制和繁殖的机制,结合病毒蛋白结构信息,为抗病毒策略提供依据。 该文章中国农业大学生物学院陈忠周教授为论文通讯作者,博士研究生马俊为本文的第一作者。封文海教授,吴玮副教授为共同作者,博士研究生马璐璐,杨美婷也参与了本研究的工作。本研究得到了国家自然科学基金的资助(32071210),国家重点研发计划(2018YFE0113100)的资助。
|

